
第三天的内容依旧精彩,前列腺癌依然是重中之重,前列腺成像新技术为前列腺癌的诊断和治疗提供了新的机遇和挑战。而免疫治疗在尿路上皮癌及肾癌中的运用正在改变游戏规则,让我们一睹为快。

免疫治疗
今天大家继续保持高涨的学习热情,七点半之前赶到主会场参加第一个有意思的环节 「Game Changing Session 」,提示我们游戏规则正在发生改变~如果不及时跟上,时代抛弃你都不会打招呼~
Game Changing Session

免疫治疗在过去的 2017 年前进了一大步。Dr.Grimm 综述了肾癌和尿路上皮癌已经完成的相关研究。越来越多的 CTLA4 和 PD-1/PD-L1 的检查点抑制剂在美国和欧洲上市。
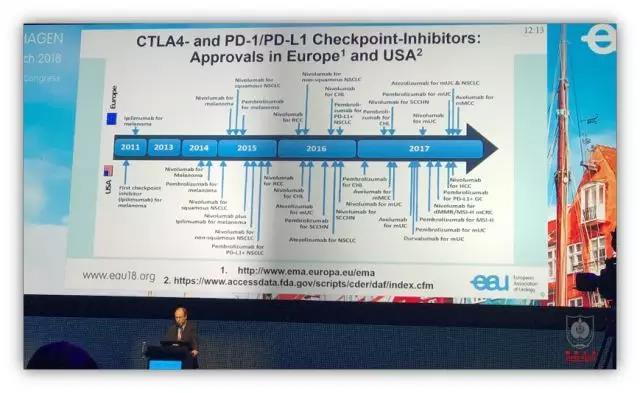
默沙东公司生产的 PD-1 单抗 pembro -lizumab 已被证实能显著延长化疗失败的膀胱癌患者的生存时间。
施贵宝公司的纳武单抗(Nivolumab)已经被 FDA 批准,成为晚期肾癌二线治疗的首选。ESMO 去年公布的 Ipilimumab 和 Nivolumab 联合免疫治疗晚期肾癌的研究结果显示,对于中高危晚期肾癌患者,联合免疫治疗的效果显著优于目前的一线治疗方案。因此,去年年底欧洲泌尿协会更新了晚期肾癌治疗指南,明确对于中高危晚期肾癌患者,首先推荐联合免疫治疗的方案。


晚期肾癌的一线治疗已被免疫治疗攻陷,而晚期膀胱癌的一线治疗也正在被挑战,我中心参加了阿斯利康公司的全球多中心临床研究,PD-L1 单抗 Durvalumab 联合 CTLA4 单抗 Tremelimumab 挑战化疗的一线地位,期待最终的研究结果。
Speciality Session
在今天的 Speciality Session 部分,来自英国 Barts Cancer Center 的 Thomas Powles 教授总结了尿路上皮肿瘤相关的最新热点和一些研究结果。目前能用于转移性尿路上皮癌的免疫检查点抑制剂包括 Atezolizumab、Nivolumab、Pembrolizumab、Durvalumab 以及 Avelumab,但是这些药物对铂类难治性尿路上皮癌的疗效有较大的变异性,因此使用这些药物需要非常谨慎。
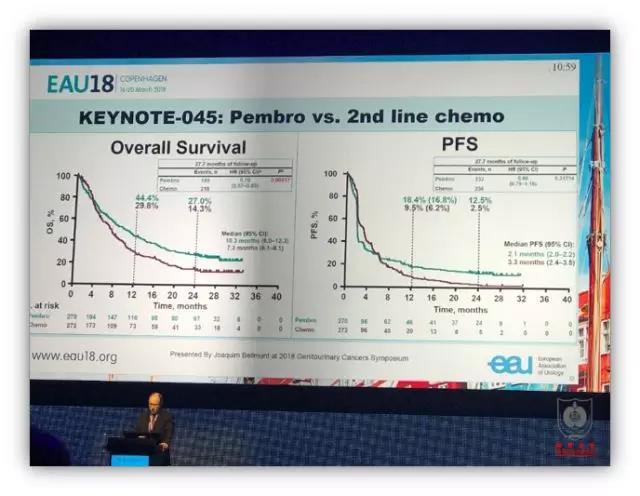
在一项比较 Pembrolizumab 和化疗在铂类难治性尿路上皮癌的疗效研究(KN-045)中,Pembro 组患者的 OS 显著高于 Chemo 组患者(中位 OS:10.3 mo vs. 7.4 mo;p = 0.0022)。另一项比较 Atezolizumab 和化疗在铂类难治性 PD-L1 阳性患者的疗效研究中,Atezo 组患者 OS 显著高于 Chemo 组患者;尽管 PD-L1 阳性患者较 PD-L1 阴性患者 OS 有显著性差异,但是 PD-L1 阴性患者与总人群的 OS 并无差异。

对于免疫检查点抑制剂在尿路上皮肿瘤中的应用,Powels 教授总结了欧洲目前的观点。铂类难治性患者的治疗目标是获得长期的持续缓解,所有的五种抑制剂都可以作为化疗之外的选择。Pembro 是目前唯一有三期临床试验支持其临床应用的药物,而 PD-L1 并没有指导意义。卡铂和免疫检查点抑制剂(Atezolizumab 和 Pembrolizumab)都可以作治疗顺铂化疗无效患者的合理选择。随后 Powels 教授又介绍了 Ramucizumab 联合多西他赛治疗铂类难治性膀胱癌的研究,联合组 PFS 显著性高于对照组,在总人群中中位随访时间为 5 个月。同时他也介绍了 FGFR 抑制剂 Erdafitinib 在转移性或不可切除的尿路上皮肿瘤中的应用前景,FGF-3 在 TCGA 管状 I 型中高表达,在一期临床实验中 11/25 患者有部分缓解。Powels 教授总结道,现在有越来越多的证据支持免疫检查点抑制剂在膀胱癌中作用,而 PD-L1 作为生物标志物并没有显著的意义,靶向治疗也逐渐在治疗中发挥作用。

对于大多数泌尿外科医生而言,免疫治疗是比较陌生的,其不良反应谱也跟既往的分子靶向治疗完全不同,因此在临床实践中需要注意免疫治疗的不良反应,严重时可能危及患者生命。
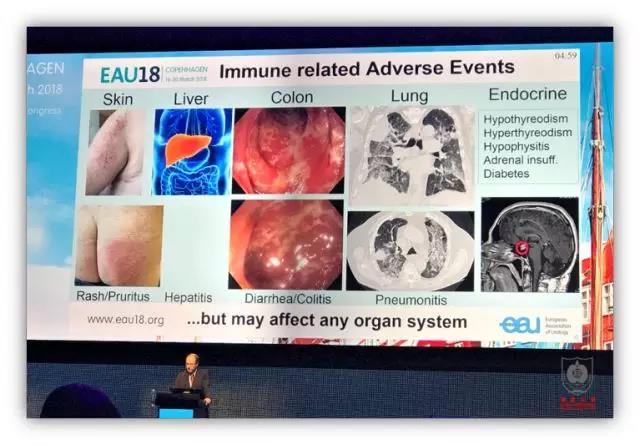
在 Game Changing Session 这一环节,Dr.Grimm 展望了免疫治疗未来的发展方向。在肾癌治疗领域,联合免疫治疗以及免疫治疗联合靶向 VEGF 的治疗是未来的趋势;尿路上皮癌领域,未来的一线治疗模式可能是 Durvalumab 联合 Tremelimumab,Nivolumab 联合 Ipilimumab ,或者免疫治疗联合化疗。

最后讲者介绍了正在进行的免疫治疗的研究,其中有大家非常期待的高危肾癌的术后辅助免疫治疗的结果。可以预计在未来的几年内,免疫治疗还会给大家带来更多的惊喜。

前列腺癌
前列腺成像的最新进展
1. 前列腺癌双参数与多参数磁共振影像
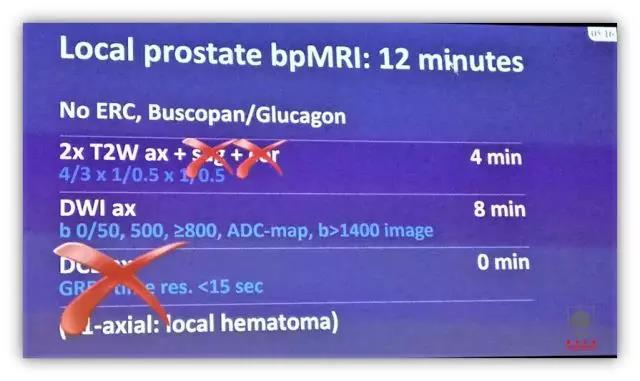
J. Barentsz 博士研究发现,采用 T2W 和 DWI 双参数(bi-parametric)磁共振检查(T2 序列需要两个方向的图像)即可获得与多参数(multi-parametric)磁共振类似的前列腺癌诊断效能,且花费的时间更少,bp-MRI 仅需 12 分钟。当然,减少参数对影像科医生提出了更高的要求,培训、诊断能力的鉴定极为重要。南京鼓楼医院泌尿外科在国内率先成立南京大学泌尿外科影像病理研究所,专业开展影像病理研究工作,服务临床和患者(4 名博士和 2 名硕士专门负责影像、病理的诊断和科研工作)。用精准的影像学检查指导临床诊疗工作,我科自 2014 年 8 月在国内率先开展磁共振超声影像融合引导的靶向穿刺技术,目前已完成 1500 余例,穿刺阳性率显著提高,感染和败血症等相关风险为 0。
2. 精密超声能否取代磁共振影像?
磁共振和超声对前列腺癌的诊断各有优势,磁共振诊断率高,而超声使用更为便捷。目前为止,市场上改进的超声设备包括 C-TRUS Anna,弹性成像/剪切波弹性成像,增强超声造影,微超声等。磁共振具有多参数的特点,能够提供更多的影像学信息用于诊断前列腺癌,而超声设备也可以通过增加参数,提供更加丰富的影像学信息,提高诊断率,传统的超声已在持续的改进中。


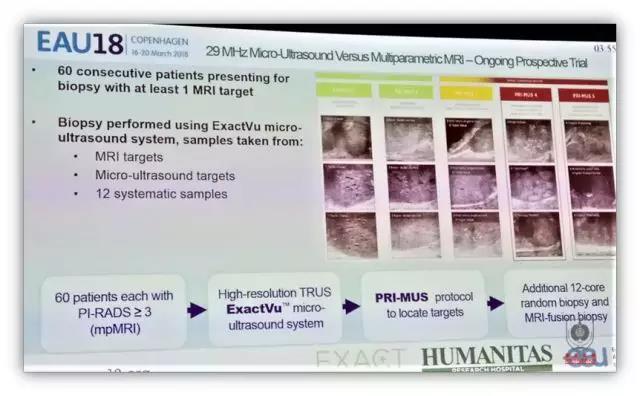
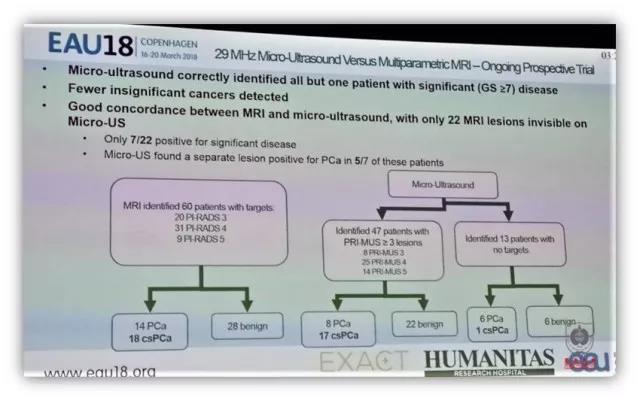
大会介绍了最新的超声产品 29MHz 微超声,有一项比较 29MHz 微超声与多参数磁共振诊断率的单中心、前瞻性实验正在进行中。29MHz 微超声的高分辨率(提高 300%)能提高临床有意义前列腺癌的诊断率,用于超声前列腺癌诊断分级系统 PRI-MUS 分层,进行靶向穿刺。与磁共振 PI-RADS 评分进行比较的初步结果提示,微超声在前列腺癌诊断和引导穿刺方面具有很好的应用前景。
3. 3D 打印在手术解剖和肿瘤靶向中的作用
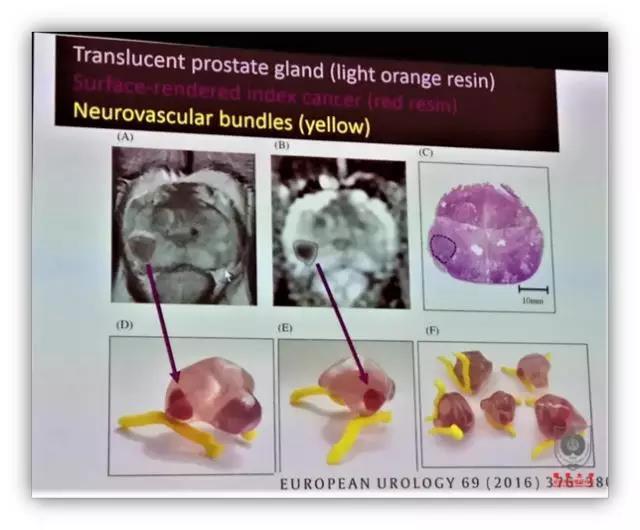
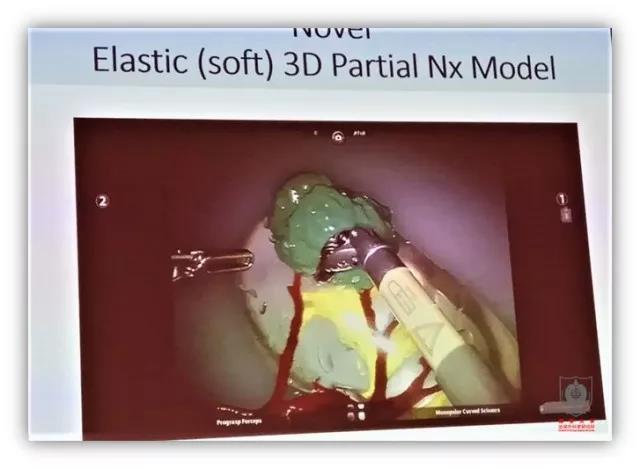
日本东京的 Osamu Ukimura 博士介绍了他们的 3D 打印能够将病灶和前列腺周围神经打印并标记出来,让医生更好地理解主要病灶的解剖位置,与周围神经血管束的关系等,避免包膜解剖产生的切缘阳性。此外,他们还打印了一些软性材料的模型,用于模拟穿刺和机器人手术。
精准影像工具时代前列腺癌诊疗的再思考
——PSMA PET/CT 诊断的寡转移前列腺癌治疗策略的争论
近年来,PSMA PET/CT 在前列腺癌诊断中的地位越来越收到的重视,与传统影像工具(如 CT、骨扫描等)相比,PSMA PET/CT 集功能与解剖于一体,大大提高了前列腺癌诊断的准确性以及敏感性。那么,在 PSMA PET/CT 应用越来越广的当下,如何制定前列腺癌的诊疗策略呢?本次 EAU 大会专门设置了一个病例讨论的专题来讨论 PSMA PET/CT 诊断的寡转移性前列腺癌的治疗策略。
病例资料:
61 岁老年男性,有前列腺癌家族史,轻度肥胖,中度尿路梗阻症状(IPSS 评分为 12/35),中度勃起功能障碍(IIEF-EF 评分为 12 分),初始 PSA 为 12.6ng/ml,复查为 11.9ng/ml,DRE 提示左叶结节(T2b),B 超提示左叶可疑结节,经直肠系统穿刺(12 针)+左侧叶结节靶向穿刺(2 针)病理提示左侧叶 4 针阳性:4+4 = 8 分,右侧叶 1 针阳性:4 = 4 = 8 分。盆腔 MR 提示左侧叶结节,无明显包膜外侵犯以及精囊侵犯,骨扫描及全腹 CT 均阴性。
基于目前的指南,该患者治疗前的检查已基本完善。患者前列腺癌诊断明确,临床分期为 cT2b,cN0,cM0,高危。基于这样的临床分期和危险分层,可选择的治疗手段也很多,包括:RP+ePLND、EBRT+ADT 等,但该患者又进行了 PSMA PET/CT 检查,结果发现了盆腔转移淋巴结一枚(6 mm),盆骨及肋骨转移各一处(均<1 cm)。因此,基于 PSMA PET/CT 的结果,该患者的临床分期应该是 cT2b,cN1,cM1b,这样的患者到底应该怎么治疗?本次讨论患者安排了三位讲者分别阐述了自己的观点:
一、系统治疗
Gillessen 教授认为系统治疗(ADT)在高危前列腺癌、转移性激素敏感性前列腺癌(mHSPC)以及转移性去势抵抗性前列腺癌(mCRPC)中发挥了至关重要的作用。该患者明确诊断为 mHSPC,基于目前的指南及临床研究结果应该使用系统治疗。CHARRTED 研究和 STEMPEDE 研究结果均说明 mHSPC 患者在 ADT 基础上给予多西他赛化疗能给患者带来生存获益,而 LATTITUDE 研究和 STEMPEDE 研究结果表明在 ADT 基础上给予阿比特龙能使 mHSCP 患者获益。
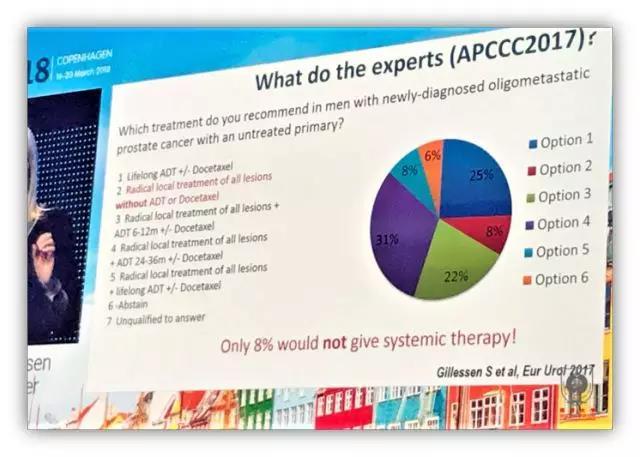
那么,对于寡转移 mHSPC 是否需要在 ADT 的基础加上上多西他赛或者阿比特龙呢?Gillessen 教授深入展开并认为 CHARRTED 研究和 LATTITUDE 研究中获益患者均为高瘤负荷患者,因此寡转移 mHSPC 能否从多西他赛或阿比特龙中获益还缺乏证据,临床使用还存在争议。最后,Gillessen 还提出传统影像学工具可能会导致转移病灶的漏诊,进而导致错误的治疗策略,但目前的指南证据均是基于传统影像学工具的评估,因此我们需要更多临床研究。
二、原发灶治疗
接着 Joniau 教授阐述认为对于寡转移患者来说单纯 ADT 是不够的。首先 Joniau 教授列举了当前高危局限性前列腺癌、极高危前列腺癌以及局部进展性前列腺癌患者中给予原发灶治疗的研究结果,原发灶的治疗联合 ADT 能够使患者获益。对于 N+的患者来说,原发灶的治疗联合 ADT 同样较单纯 ADT 能够延长患者的生存时间。目前指南均推荐区域放疗+长程内分泌治疗作为高危前列腺癌、局部进展性前列腺癌甚至伴有区域淋巴结转移(N+)患者的 A 级推荐治疗手段。

此外,Joniau 教授还提出了对寡转移患者原发灶治疗的临床基础:能够避免原发灶进展相关的并发症如下尿路梗阻、感染、出血以及疼痛等。同时,这部分患者进行原发灶治疗也有一定的生物学基础:能够避免原发灶导致的远处转移,避免循环肿瘤细胞的自体种植、逆转肿瘤导致的免疫抑制等。接着,Joniau 教授列举了关于寡转移患者从减瘤手术中获益的研究,虽然多是回顾性研究,但阳性结果令人振奋。目前,很多关于寡转移患者原发灶治疗的前瞻性研究正在开展。Joniau 教授认为寡转移患者的原发灶治疗或许能够改善患者的预后,但仍需要更多的前瞻性研究结果来支持这一观点。

三、转移灶治疗
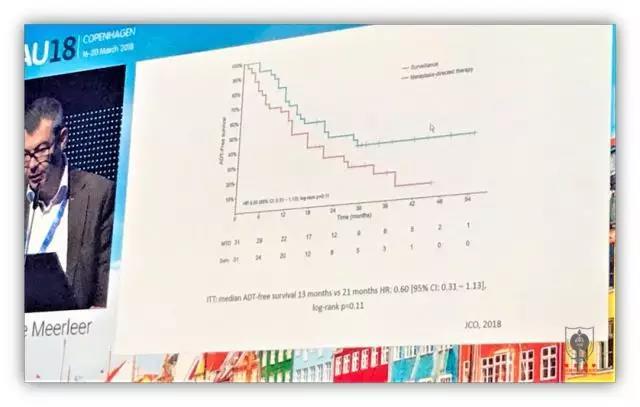
风趣幽默的 Meerleer 教授登场,阐述了对寡转移患者转移灶治疗的观点。首先,Meerleer 教授认为寡转移患者的临床特征与 CHARRTED 研究和 LATTITUDE 研究中获益患者的特征不同,因此他不主张寡转移患者使用多西他赛或者阿比特龙治疗。相反,对于可见病灶的治疗可能是使这部分患者获益的关键。接着 Meerleer 教授介绍了前列腺癌转移规律,和原发灶一样,前列腺癌转移灶也能引起新的转移病灶。这就为寡转移患者转移灶的治疗提供了理论基础。然后 Meeleer 教授列举了一些寡转移患者仅实施可见病灶治疗进而延缓 ADT 治疗的研究,结果让人吃惊,寡转移患者转移病灶的治疗能够使这部分患者中位延缓 ADT 使用时间 44 个月。除此之外,目前还有关于寡转移可见病灶治疗的 RCT 研究(STOM),前期结果显示,转移病灶治疗能够中位延缓 ADT 使用时间为 8 个月(13 个月 Vs 21 个月)。当然我们更期待这个 RCT 结果在肿瘤生存方面的阳性结果。
讨论总结
最后 EAU 前列腺癌部分的主席对本次讨论做了精彩的总结。他认为 PSMA PET/CT 的优势不言而喻, PSMA 检查的引入使 21% 的既定治疗策略发生了改变,但其临床影响仍不清楚。当前指南推荐 mpMRI 作为局部 T 分期的工具,而全腹 CT 和骨扫描作为全身 M 分期的工具,当前并没有研究证据支持 PSMA PET/CT 的优势。关于原发灶治疗,他认为虽然目前有回顾性研究表明原发灶治疗给患者带来的获益,但没有前瞻性研究结果。因此,目前对于 M1 患者除临床研究外仍不建议使用 ADT+原发灶治疗,但他同时也强调这些临床分期都是基于传统的影像学工具。关于转移灶治疗的问题,寡转移的概念本身就存在争议(转移数目说法不一),而且研究结果中所谓推迟 ADT 使用时间是不是能够代表真实的获益情况都存在争议。
指南等待证据去更新,但证据没有出现之前作为泌尿外科医生的我们应该怎么去思考。PSMA PET/CT 的问世使我们把前列腺癌看的更透彻(发现可能被忽略的病灶),但同时也给我们的临床工作提出了新的挑战,关于这部分患者的治疗以及获益情况是否还能遵循当下的指南(当下指南的证据均是基于传统影像学工具,尤其是骨扫描)?
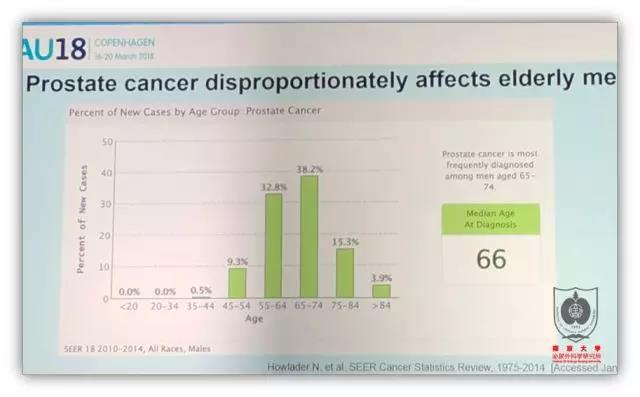
高龄前列腺癌患者的治疗选择
我们正面临一个老龄化的世界, 2050 年全球超过 65 岁老年人群的比例将是现在的两倍。高龄前列腺癌患者的治疗是临床工作中经常遇到的难题,前列腺癌高发于 65-74 岁男性,中位发病年龄 66 岁。大会以一例 85 岁前列腺癌患者为例讨论了高龄非转移性局部进展性前列腺癌患者的治疗选择。
患者资料
患者 85 岁,有可控的高血压及 2 型糖尿病,既往有冠状动脉搭桥手术史,ECOG 评分 1 分。有中度下尿路症状(排尿等待、尿线细、夜尿 3 次),PSA 25 ng/ml,前列腺体积 25 g,临床分期 T3b(右侧)。穿刺活检 Gleason 评分 4+4,无远处转移证据。

方案对比
首先,我们要区分时间年龄和生物学年龄。所谓生物学年龄指根据个体的生理学和解剖学状况确定的年龄,取决于组织器官结构和功能退化程度。生物学年龄和时间年龄并不相同,个体老龄化评估直接影响治疗决策。简单的预期寿命评估为当地平均寿命减去患者实际年龄,如果患者健康状态在同年龄段人群中居于前 25%,则其预期寿命增加 50%;后 25% 则减去 50%。具体评估包括患者精神状态、营养、体能、认知、社交和伴发疾病等多种量表,EAU 推荐 G8 和 mini-COG 评估工具,对患者总生存期和治疗效果有明显影响。
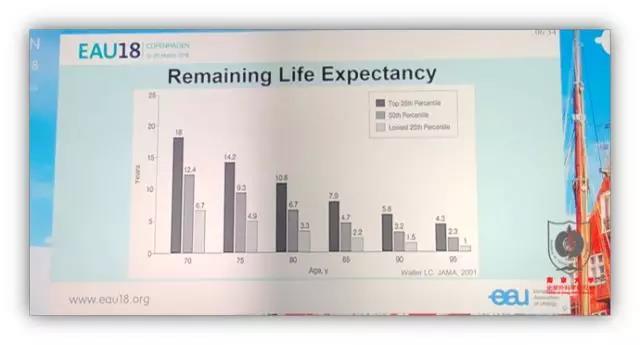
随着前列腺癌患者年龄增大,内分泌治疗所占比例逐步增加,80 岁以上患者 ADT 治疗的比例高达 60.1%。然而长期内分泌治疗的并发症十分明显,包括肌肉减少、疲劳、骨质疏松、活力降低、心血管疾病等。探索高龄患者系统性治疗包括局部治疗策略十分必要。既往研究显示对于局部高危前列腺癌,与单纯内分泌治疗相比,内分泌治疗+放疗可明显提高总生存率。长程内分泌治疗(36 个月)总生存期优于短程内分泌治疗(6 个月)。18 个月的内分泌治疗与 36 月相比,无转移生存率(MFS)、OS 和肿瘤特异性死亡率(CSS)无明显差别,但 18 月疗程的生活质量评分更高。GETUG 12 研究显示 ADT+多西他赛化疗无复发生存率优于单纯 ADT。STAMPEDE 研究显示标准内分泌治疗+阿比特龙无失败生存率(FFS)优于单纯内分泌治疗。2016 年发表于 Lancet Oncology 的一篇囊括了 GETUG 12、RTOG OS21、STAMPEDE 和 TAX3501 的荟萃分析结果也指出内分泌治疗+化疗或阿比特龙的效果优于单纯内分泌治疗。

因此,当患者预期寿命大于 5 年时,推荐内分泌治疗+放疗,内分泌治疗时间建议为 18-24 个月。多西他赛或阿比特龙联合内分泌治疗目前仍处于试验性阶段,等待进一步随机对照试验的结果。大会同时建议,未来随机对照研究不应该随意排除高龄患者。

前列腺癌系统治疗再优化
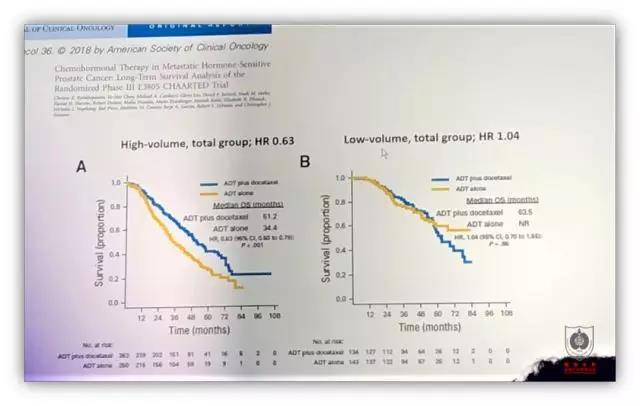
前列腺癌的重头戏除了之前的辩论之外,如何进行系统治疗一直是大家关注的热点。CHARTTED 研究和 STAMPEDE-docetaxel 研究均证实了 ADT 联合多西他赛可以延长患者的 OS,而 GETUG15 研究并未得到阳性的结果。2018 年公布的 CHARTTED 长期随访数据显示,对于高瘤负荷的 mHSPC 病人(所谓高瘤负荷病人定义为存在内脏转移灶和/或 ≥ 4 个骨转移灶,且至少有一处在脊柱和骨盆外),ADT 联合化疗可以明显增加病人的 OS,但是对于低瘤负荷的 mHSPC 病人两者联合使用并未使病人得到获益。此外 LATTITUDE 研究和 STAMPEDE-abiraterone M1 arm 研究也证实了阿比特龙+ADT 相较于单纯 ADT 可以延长生存期。那么对于阿比特龙和多西他赛化疗二者之间的选择,需要综合包括药物毒性、花费等多种因素进行考虑。治疗的选择需要综合患者因素(合并症等),肿瘤负荷情况(低或高负荷)等。
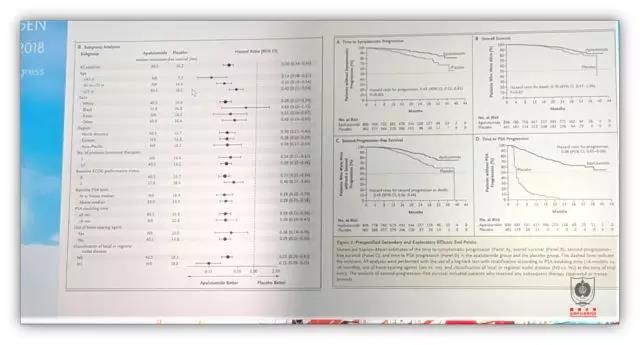
那么对于去势抵抗性前列腺癌(mCRPC)的最新研究有哪些?2018 一篇最新报道证明了循环肿瘤 DNA(ctDNA)与前列腺癌转移灶穿刺结果的一致性。在大多数患者中,ctDNA 检测足以识别转移组织中 DNA 的变化,可以开发一种 DNA 标志物用来指导 mCRPC 患者管理。而另一项研究证实了恩杂鲁胺对于部分使用过阿比特龙+强的松 24 周的患者具有一定的抗肿瘤效果。FIRSTANA 研究在未经化疗的 mCRPC 患者中,证实了两种卡巴他赛剂量 20 mg/m2 及 25 mg/m2 相较于多西他赛 75 mg/m2 没有明显优势,但是卡巴他赛剂量 20 mg/m2 的毒性要低于多西他赛。著名的恩杂鲁胺在非转移 CRPC 患者中的研究结果证实相较于安慰剂组,患者进展为 M1CRPC 的风险可降低 71%。而最新的雄激素受体通路抑制剂阿帕鲁胺可明显降低前列腺癌患者的转移风险。

最后,来自美国波士顿的 Nguyen 博士向大会介绍了 ASCO GU 会议的最新内容,并欢迎大家参加明年旧金山的会议。2018 年 ASCO GU 会议共有美国参会者 2062 人,非美国参会者 2088 人,其中鼓楼医院泌尿外科也派出了杨荣、纪长威、邱雪峰、张青、张成伟的 5 人小分队参加了此次会议,受益匪浅。具体内容欢迎参见本公众号 2018 年 ASCO GU 报道。


肾肿瘤
本次会议肾癌的话题热度远远比不上尿路上皮肿瘤,更不用说前列腺癌。今天肾癌的内容是关于保留肾单位术后肾功能的评估和预测的 poster 章节。
精彩壁报
来自韩国延世大学泌尿外科的研究提出了预测 NSS 术后肾功能不全的 Nomo 图,提出患者年龄,性别,术前肾功能,肿瘤最大径以及是否有糖尿病作为主要指标能够预测患者术后 5 年内 CKD 的概率。

来自米兰的研究比较了常规的术中肾蒂阻断的 NSS 和未阻断的 NSS,发现阻断组慢性肾功能不全的概率增加了 7 倍,认为不阻断肾蒂血管是最理想的术式,但同时也有研究也认为短时间的阻断肾蒂血管,不会影响远期的肾脏功能。
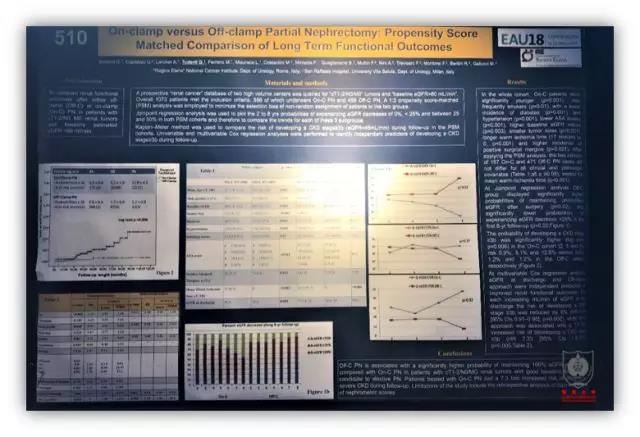
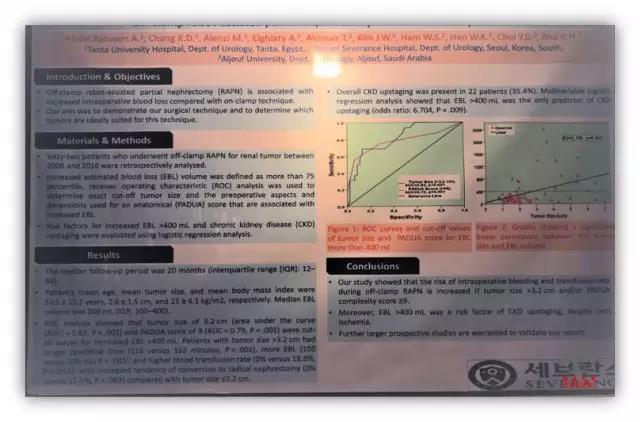
来自延世大学的另一项不阻断肾蒂血管的肾部分切除术的研究结果认为,当肿瘤直径超过 3.2 cm,PADUA 评分高于 9 分时,术中出血量和输血概率显著增加,同时研究还发现,当出血量超过 400 ml 是术后发生 CKD 的高危因素。
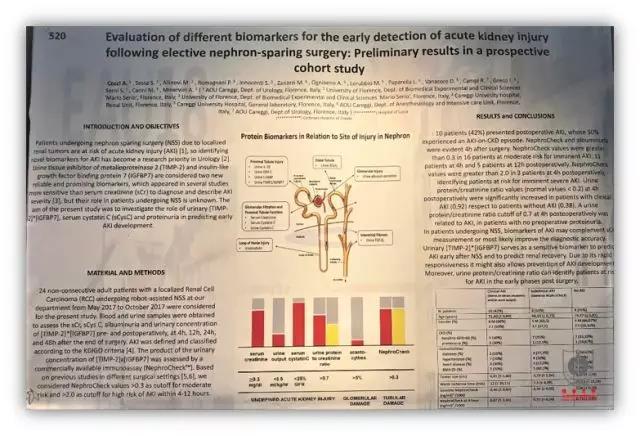
来自我中心合作单位意大利佛罗伦萨大学附属医院研究提出了检测 NSS 术中肾损伤的新的指标,其开发了名为 NephroCheck 的试剂盒,联合检测 TIMP-2 和 IGFBP7,当 NephroCheck 大于 0.3,提示有一定的风险,当该指标大于 2.0 时,提示在 4-12 小时内发生 AKI 的风险极高。
(本文转载自南京鼓楼医院泌尿外科微信公众号)