背景:
HIV 合并梅毒患者快速梅毒血清反应素试验(RPR)通常下降缓慢。目前早期梅毒患者的推荐治疗为 240 万单位苄星青霉素(BPG)肌注。一些观察性研究显示,在混合感染患者中该种疗法有较高的治疗失败率。
方法:
我们进行了一项非盲随机对照研究,来对比单次剂量 BPG 和三次剂量的 BPG 治疗早期梅毒合并 HIV 感染的疗效。每三个月检测一次 RPR 滴度。治疗成功定义为随访 12 个月内 RPR 滴度下降 ≥ 2 个稀释度(4 倍)。
结果:
共入组 64 例患者。在意向性处理分析中,单次剂量组和三次剂量组治疗成功率分别为 80%(28/35)和 93%(27/29)(绝对差,13%[95% 可信区间 {CI}, –5% to 30%]; P = .17)。按方案分析,单次剂量组和三次剂量组治疗成功率分别为 93%(27/29)和 100%(绝对差,7%[95% CI, –7% to 22%]; P = .49)。CD4 计数,RPR 滴度和梅毒分期不影响治疗结果。
结论:
相对于单次剂量的苄星青霉素,三次剂量的治疗方案不能提高梅毒血清学治疗效果。我们的结果支持疾病预防控制中心推荐的 HIV 合并早期梅毒患者使用单次剂量的苄星青霉素治疗方案。
关键词:HIV;梅毒;苄星青霉素;临床试验。
梅毒仍然是全球范围内重要的健康问题,每年大约有 1 千 6 百万新发病例。在美国,经历了 2000 年的低谷,从 2001 年至 2009 年一期和二期梅毒的发病率持续增长。2010 年的总发病率经历了 10 年中的首次下降。但 2011 年的发病率仍未改变,从 2011-2013 年发病率增加了 22%。由于有共同的传播途径和危险因素,梅毒合并人类免疫缺陷病毒已并不少见。在美国,合并感染率在男男同性恋人群中尤其高,2013 年报告的发病率由洛杉矶的 15.8% 到费城的 47.4%。
对于 HIV 合并梅毒感染的患者,少有研究评估他们对治疗的反应。这些研究都是在高效抗逆转录病毒治疗(HAART)问世前进行的。结果显示这些患者在治疗后 RPR 滴度下降的更缓慢,而且他们更容易在病程的早期发展为神经梅毒。这就导致了关于治疗早期梅毒增加青霉素总剂量的需求。
疾病预防控制中心(CDC)性传播疾病治疗指南主张 HIV 合并一期或二期梅毒患者治疗使用同 HIV 阴性梅毒患者相同剂量的青霉素。这项建议在最近几次的指南更新中仍未改变。治疗方案主要依据一项前瞻性随机研究,研究结果显示使用 240 万单位苄星青霉素和额外增加 10 天阿莫西林和丙磺舒治疗的患者并无明显的临床疗效的差别。然而在入组的 541 名患者中,仅有 18.7% 的患者有 HIV 感染。此外该研究在 12 个月是的随访率很低(52%)。
据我们所知,目前没有意向随机对照研究来对比单剂苄星青霉素和三次变性青霉素治疗早期梅毒合并 HIV 患者的疗效。观察性研究的结果也不相一致。在一项单中心研究中,结果显示相较于 720 万单位苄星青霉素治疗的患者,240 万单位治疗方案的失败率更高,失败率分别为 5% 和 28%。由于指导梅毒合并 HIV 感染患者处理的证据有限,因此有 62% 的感染科专家不听从指南的推荐而处方 3 次剂量的苄星青霉素治疗二期梅毒。
我们进行了一项随机对照研究,来对比单次苄星青霉素和三次苄星青霉素治疗早期梅毒合并 HIV 患者的疗效。
方法
研究设计
我们在包括 Thomas 街道卫生院、西北诊所(Harris 医疗体系)和田纳西休斯敦的 Michael
E. DeBakey 退伍军人医疗中心(MEDVAMC)在内的 3 家临床中心,进行了一项前瞻型、随机、开放式研究。这项研究获得了 Baylor 医学院的机构审查委员会、Harris 医疗体系研究办公室以及 MEDVAMC 研究与发展委员会的批准。
患者
本研究患者的入选标准为年龄 ≥ 18 岁,经过酶联免疫吸附实验和 Western blot 实验确诊的 HIV 感染,以及未经治疗的早期梅毒(定义为一期、二期和早期潜伏梅毒)患者。梅毒的诊断基于快速梅毒血清反应素实验(RPR)和梅毒螺旋体明胶颗粒凝集实验(TP-PA)阳性。RPR 和 TP-PA 在 Harris 医疗体系(Thomas 街道卫生院和西北诊所入选的患者)和 MEDVAMC(该处入选的患者)的中心实验室进行。同时有生殖器、肛周或口咽部溃疡的患者划分为一期梅毒。执业医师(医师或助理医师)进行全面的临床查体,特别关注一期和二期梅毒的体征,包括局部淋巴结的评价。如果有皮疹或黏膜损害的患者划分为二期梅毒。仅有血清学阳性而无其他疾病证据,且有 12 个月内血清检测阳转或 ≥ 4 倍升高的记录者,划分为早期潜伏梅毒。排除标准为青霉素过敏史,晚期潜伏梅毒,最近两周使用过强效抗梅毒螺旋体的抗生素(包括大环内酯类、四环素类和头孢菌素类)。
治疗和随访
签署知情同意书后,我们随机把患者分至单次肌注 240 万单位 BPG(标准疗法)或每周肌注一次 240 万单位 BPG 连续 3 周(增强疗法,总剂量为 720 万单位)。使用随机数表进行简单随机分组。所有的注射均为研究中心经过训练的护士完成。腰穿不是本研究的一项流程,但可由治疗医师自行决定。
患者在初次访视时需记录症状、性行为间隔和给药间隔,在随后的第 3、6、9、12 个的访视中亦需记录上述信息。初次和随后访视的血清样本需要进行梅毒检测。在每次访视时其他相关的实验室结果也需要收集。治疗成功定义为在 12 个月随访中,RPR 滴度比初次下降 ≥ 2 个稀释度(4 倍)。预先设定的亚组的治疗结果也需要分析,包括基线 CD4 计数(≤ 350 个/ul 和>350 个/ul),基线 RPR 滴度(<32 和 ≥ 32),病毒学抑制(HIV RNA ≤ 50 拷贝/毫升)和梅毒分期(一期、二期和早期潜伏)。
统计学分析
意向性治疗和方案分析两者都进行了分析。意向性治疗分析包括了所有进行随机化的患者。对于数据丢失的患者,我们认为这些患者治疗失败。在按方案分析中,我们排除了失访患者(5 人)和在标准治疗方案组接受了额外剂量的 BPG 患者(1 人)。
根据 2 尾计算样本量,2 样本的比例比较使用 0.05 的Ⅰ类错误。我们假设增强疗法组治疗成功率为 95%(或失败率 5%),标准疗法组成功率为 75%(或失败率 25%)。检验效能设定为 80%。根据这些参数,每组需要的样本量为 59 例(共 118 例)。
我们使用传统的中心位置和分散度来描述数据。两组患者的特征中的连续变量,我们使用的 Student T 检验来比较,分类变量使用卡方检验或 Fisher 精确检验。95% 可信区间(CI)为主要的报告结果。P 值<.05 认为有统计学意义。
结果
研究群体
从 2009 年 6 月到 2013 年 4 月共筛选 108 名患者,其中 64 名患者入选该研究。在入选的患者中,35 名被随机分至标准疗法组使用单次剂量 BPG,29 名患者分至增强疗法组使用 3 次 BPG。两组患者的基线特征见表 1。该研究患者的平均年龄为 35 岁。主要为男性(95%)和男同性恋(84%)。两组间 37 人(58%)为非裔美国人,20 人(31%)为西班牙裔,7 人(11%)为白种人。4 人(6%)为一期梅毒,39 人(61%)为二期梅毒,21 人(33%)为早期潜伏梅毒。38 人(59%)之前曾诊断过梅毒,平均 CD4 计数为 388 个/uL,64% 患者在梅毒诊断时在接受 HAART。其中 19 人检测不到 HIV-RNA。中位 RPR 滴度为 1:128(四分位距 1:32-1:256)。两组间的基线特征无统计学差异。
治疗反应
在意向性治疗分析中,12 个月随访时标准疗法组的治疗成功率为 80%(28/35),增强疗法组为 93%(27/29)(绝对差,13%[95% 可信区间 {CI}, –5% to 30%]; P = .17)。两组在随访结束时(12 个月)RPR 的集合平均滴度均有显著下降。标准疗法组失访的 5 名患者中的 2 人分别在 18 个月和 24 个月回访,RPR 滴度均有 ≥ 4 倍的下降。
在事后分析中,除去入组后一年 RPR 未转阴的早期潜伏患者,标准疗法和增强疗法组的治疗成功率分别为 80%(24/30)和 90%(19/21)(P =.45)。
按方案分析,标准组和增强组的治疗成功率分别为 93%(27/29)和 100%(27/27)(绝对差,7%[95% CI, –7% to 22%]; P = .49)。2 名对单剂 BPG 治疗无反应的患者 12 个月的 RPR 分别为 1:4 和 1:32,基线 RPR 分别为 1:2 和 1:16。
在至少有一次随访在患者中,9 名患者经历了血清转换(RPR 阴性)。这其中 4 名在标准疗法组 5 名在增强组(P =.72)。
基线 CD4 计数 (≤ 350 and >350 cells/μL),HIV-RNA 载量,入组时使用抗病毒治疗,入组时 RPR 滴度 (<32 and ≥ 32) 或梅毒分期(一期、二期和早期潜伏)的亚组疗效评估并未显示出显著的变化。这些检测不到 HIV-RNA 病毒载量的 20 名患者中,仅有 1 人(5%)未治疗成功。这名患者仅接受了单次剂量的 BPG 治疗。与此相反,44 名可以检测到 HIV-RNA 载量的患者中,8 人未治疗成功(P =.25)。6 人接受了单剂 BPG 治疗 2 人接受了 3 次 BPG 治疗。
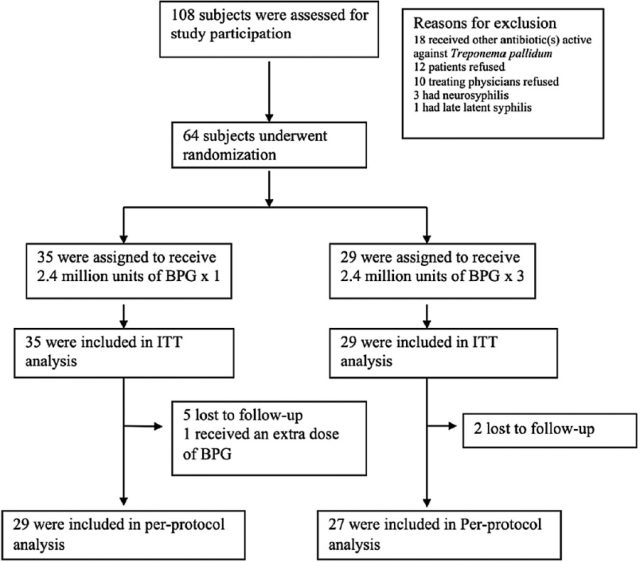
图表 1. 研究流程图. 缩写:BPG,苄星青霉素;ITT,意向性治疗
不良反应
我们未观察到任何 BPG 注射后的吉海反应。在我们研究 12 个月的随访中无任何一个人出现神经症状。
无死亡记录。
讨论
据我们所知这是第一例对比单剂 BPG(标准疗法)和三剂 BPG(增强疗法)治疗 HIV 合并早期梅毒患者的随机临床研究。
我们发现两组的治疗成功率无显著区别,成功治疗定义为 12 个月时 RPR 下降 4 倍。意向性治疗分析和按方案分析总的血清反应率分别为 82% 和 93%,与之前报道相似。此外,根据基线 CD4 计数 (≤ 350 and >350 cells/µL),入组时 HAART,HIV 病毒学抑制,基线 RPR 滴度 (<32 and ≥ 32) 和梅毒分期(一期、二期和早期潜伏)对比出的临床疗效均无差别。
单剂 BPG 组的两名患者在 12 个月时 RPR 滴度无 4 倍以上的下降。然而随访计数后他们最终实现了 RPR 的滴度下降。之前的一项研究显示大约有 6% 的早期梅毒合并 HIV 感染患者在治疗后的 12-24 个月 RPR 下降 ≥ 4 倍。
一个前瞻性观察性研究显示单剂 BPG 治疗 HIV 合并早期梅毒感染者比三次 BPG 的血清失败率更高,出现治疗失败的时间更短。在这项研究中,那些治疗后最初经历了成功治疗,而后出现了 RPR ≥ 4 倍的升高,被认为是治疗失败。这些患者可能在恰当治疗后发生了再感染。当排除这些患者,两组患者治疗成功率没有区别(单次剂量 88.1% 三次剂量 86%)。其他研究显示两种疗法(1vs3 次 BPG)有相似的疗效。
我们的结果支持了这项假设——HIV 感染不影响早期梅毒患者 BPG 治疗后的血清反应。在非 HIV 感染患者中评估 BPG 替代治疗,例如阿奇霉素,也是有必要的。
我们的研究有一些局限。首先由于缓慢的入选导致样本量小于预期,使我们的研究可能低估了我们在不同治疗组的治疗结果间检测到的微小但有临床意义的差距,尤其在可检测到 HIV-RNA 载量的早期潜伏梅毒患者中。其次,我们的研究中有 64% 的患者在梅毒诊断时已经在 HAART,平均 CD4 为 388 个/uL。尽管这个比例在使用抗病毒治疗的期望范围内,但是我们的结果不适用于有更严重免疫抑制或者未抗病毒治疗的群体。然而,所有 11 名标准治疗组合 5/6 的增加疗法的患者都有一个良好的血清学反应,这些患者在梅毒诊断时的 CD4<299 个/uL。第三,我们使用非梅毒螺旋体抗体滴度 ≥ 4 倍作为结果判断标准。尽管血清学反应是评价梅毒疗效的代表指标,但这种血清反应的临床意义仍不清楚。
Oboho 等人报告 HIV 感染者的非梅毒螺旋体滴度相较于梅毒活动受其他因素影响更大,例如使用抗逆转录病毒药物和静脉吸毒。此外包括 Tuddenham 和 Ghanem 在内的一些学者倡导当评估梅毒疗效时使用面向临床的主要结果,例如神经梅毒的进展。我们的研究没有设计比较两组间的神经梅毒发生率。尽管没有在研究的任何部分进行腰穿操作,但在 12 个月的随访中,无一例患者出现神经梅毒的相关症状。
综上所述,结果显示相较于单剂 BPG,3 剂 BPG 并不会改善 HIV 合并早期梅毒患者的临床疗效。但仍需要更大规模更理想的多中心研究来证实该结论。同时,我们的结果佐证了当前 CDC 推荐的对 HIV 合并早期梅毒患者使用单剂 BPG 治疗的方案。
