3500
II/III 期高危结肠癌患者接受 3 个月或 6 个月 FOLFOX 或 CAPOX 方案辅助化疗对比:IDEA 研究中希腊肿瘤研究组(HORG)的疗效结果汇报
Ioannis Sougklakos, University ofHeraklion, Heraklion, Greece
译者:李珊珊
背景:IDEA 研究目的在于探讨在 II/III 期高危结肠癌(CC)患者中,接受 3 个月(3M)的基于奥沙利铂/氟尿嘧啶的辅助化疗,其 3 年无病生存(DFS)是否不劣于接受 6 个月(6M)辅助化疗。
方法:HORG-IDEA 研究把患者随机分为接受 3 个月或 6 个月的 FOLFOX 方案或 CAPOX 方案,主要的研究终点是 3 年无病生存(3yDFS)。
结果:从 2009 年 5 月至 2015 年 10 月,研究总共纳入 1121 例患者,其中 413 例是高危 II 期结肠癌,708 例为 III 期结肠癌。中位随访时间为 67(38-126)个月。高危 II 期组别共有 79 个 DFS 事件(3M 组有 43 例,6M 组 38 例),3M 组和 6M 组的 3yDFS 分别为 82.7% 和 83.4% (HR: 1.05; 95%CI: 0.68-1.63, p = 0.829)。相似地,III 期患者组别共有 214 个 DFS 事件(3M 组有 161 例,6M 组 153 例),3M 组和 6M 组的 3yDFS 分别为 72.9% 和 74.1%(HR = 1.06; 95%CI: 0.81–1.42, p = 0.622)。接受 FOLFOX 方案的高危 II 期患者,3M 组和 6M 组的 3yDFS 分别为 76.7% 和 79.3% (HR = 1.21; 95%CI: 0.54–2.70, p = 0.641)。接受 CAPOX 方案的高危 II 期患者,3M 组和 6M 组的 3yDFS 分别为 85.4% 和 83.8%(HR = 0.99; 95%CI: 0.59–1.67, p = 0.968)。对于接受 FOLFOX 方案 III 期 CC 患者,3M 组和 6M 组的 3yDFS 分别为 71.5% 和 77.3% (HR = 1.18; 95%CI: 0.74–1.86, p = 0.479)。接受 CAPOX 方案的 III 期 CC 患者,3M 组和 6M 组的 3yDFS 分别为 74.5% 和 74.7% (HR = 0.99; 95%CI: 0.70–1.44, p = 0.991)。
结论:HORG-IDEA 研究的结果与国际 IDEA 研究结果是相符的,提示 3yDFS 取决于不同的辅助化疗方案,对患者应个体化选择不同的化疗方案和化疗时长。
临床研究信息: NCT01308086
3501
4 项关于高危 II 期结肠癌(CC)接受不同时长的基于奥沙利铂的辅助化疗(3 个月 vs 6 个月)随机临床研究的前瞻性荟萃分析
Timothy Iveson, University HospitalSouthampton NHS Foundation Trust, Southampton, United Kingdom
译者:李珊珊
背景:高危 II 期(合并 T4,淋巴结清扫数目不足,低分化,肠梗阻,穿孔或脉管/周围神经浸润)的 CC 患者可选择 6 个月(6M)基于奥沙利铂的辅助化疗方案。IDEA 研究提示对大部分 III 期结肠癌患者来说,接受短程的辅助化疗是合适的。这里将汇报 4 项 IDEA 研究中 II 期患者的结果。
方法:这是一个前瞻性、预先计划的荟萃分析,主要针对 4 项同时进行的随机 III 期临床研究(SCOT,TOSCA,ACHIEVE-2,HORG)中的高危 II 期患者进行分析,评估 3 个月(3M)对比 6 个月(6M)的 FOLFOX/CAPOX 辅助化疗方案(提前选定方案,非随机)的非劣效性(NI)。主要的研究终点是无病生存(DFS),假如通过一个分层 COX 模型预估的 DFS 风险比(HR 3m vs. 6m)的双侧 80% 置信区间(CI)是小于 1.2,则达到非劣效性。为达 80% 的效力,共需要 542 个 DFS 事件来判定 NI。同时在不同的方案间,T4(是或否)和淋巴结清扫数目不足(是或否)等预设的亚组间也会检验 NI。
结果:初始分析共纳入了 3273 例的随机化患者,其中 1254 例接受了 FOLFOX 方案,2019 例接受了 CAPOX 方案化疗。研究中共有 552 个 DFS 事件,中位随访事件为 60.2 个月。3M 组的 3-5 级毒性显著更少(p = 0.0001)。3M 组和 6M 组的 5 年 DFS 为 80.7% 和 84%,估计 DFS HR 为 1.18 (80% CI:1.05-1.31, p for NI = 0.404)。对于 CAPOX 方案,估计 HR 值为 1.02 (80%CI:0.88-1.17, p for NI = 0.087),对于 FOLFOX 方案,估计 HR 值为 1.42 (80%CI:1.19-1.70, p for NI = 0.894)。化疗时长和化疗方案间的交互检验结果并无统计学差异 (p = .174 已作多方检验校正),但比其他亚组检验的结果要强。
结论:在总体高危 II 期 CC 患者中,3M 的非劣效性未达到。在 III 期患者中,辅助化疗方案的选择显得很重要(尽管这并没有达到统计学差异),因为如果辅助化疗方案为 CAPOX,3M 和 6M 组之间 DFS 存在一点差异。
临床研究信息:ISRCTN59757862
3504
FOxTROT: 一项纳入了 1052 例结肠癌患者评估新辅助化疗的国际多中心随机对照临床试验
Matthew T. Seymour, National Institutefor Health Research Clinical
译者:胡华斌
背景:新辅助化疗已经在多种实体肿瘤中证明有效,但是对于结肠癌尚未进行过大规模的临床试验评估。
方法:纳入可手术切除的没有梗阻的,CT 评估为 T3-4,N0-2 和 M0,并且身体状况可以耐受 FOLFOX 方案化疗或者手术的结肠癌患者。入组患者按照 2:1 随机分至新辅助治疗组(术前 3 程 FOLFOX 方案化疗+手术+术后 9 程 FOLFOX 方案化疗)或者对照组(手术+术后 12 程 FOLFOX 方案化疗)。对于老年或者低危的患者可以接受总疗程 6 程的化疗替代 12 程,以及 OxCap 方案替代 FOLFOX 方案。主要研究终点是 ITT 人群的 2 年的无复发和疾病残留。次要研究终点包括安全性、病理分期和完整切除率。
结果:2008 年 6 月至 2016 年 12 月,1052 例患者在英国、丹麦和瑞典的 85 家中心入组随机。
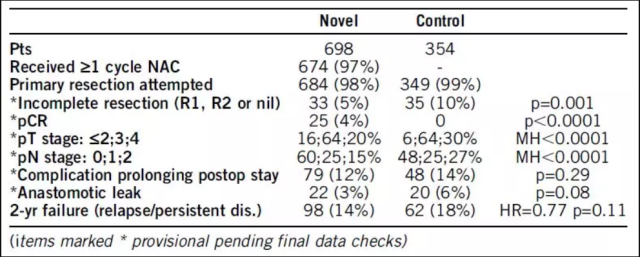
图 1 研究结果
结论:新辅助化疗耐受性良好且安全,围手术期并发症没有增加,且术后严重并发症较少。接受新辅助化疗后 59% 的患者出现组织学退缩,包括一些 pCR 的患者。这导致显着的病理降期和不完全切除率的减半。研究观察到 2 年失败率的改善(HR = 0.77),但没有达到统计学意义(p = 0.11)。新辅助化疗用于结肠癌可提高手术效果,现在可视为一种治疗选择; 但也需要更长时间的随访和进一步的试验来确认长期效益,改进其使用并优化病例选择。
临床试验信息:87163246
3505
NRG-GI002 研究:局部进展期直肠癌全新辅助治疗模式的 II 期临床研究---第一个研究组的初步结果
译者:张剑威
Thomas J. George, NRGOncology, and The University of Florida Health Cancer Center, Gainesville, FL
背景:该项 NCTN 多臂随机 II 期临床研究,通过模块化临床研究平台,在局部进展期直肠癌中利用全程新辅助治疗平行对照联合不同试验组进行探索。该研究试验组间并非直接比较,而是用相关生物标记物探索在同样的高风险患者人群中的各种研究假设。本次主要报道其中使用 PARP 抑制剂 Veliparib 联合同步放化疗的研究队列的主要终点及可及的次要研究终点(NCT02921256)。
方法:II /III 期的局部进展期直肠癌(存在以下任何一种情况:低位直肠 [cT3-4,距肛缘<5 cm,任何 N]; 体积大 [任何 cT4 或浸润直肠系膜筋膜 3 mm 内的肿瘤]; 转移风险高 [cN2]; 或拟行非保留括约肌手术 [SSS])被随机分配到新辅助 FOLFOX 方案化疗 4 个月→随后进行放化疗(卡培他滨联合 50.4 Gy 放疗 +/- veliparib 400 mg Bid 口服)→放化疗后 8-12 周手术后。主要研究终点:新辅助直肠癌(NAR)评分降低 4 分,单侧α = 0.10 和效能 80%,NAR 通过线性模型控制分层和可能的其他因素进行比较。次要研究终点:OS,DFS,安全性,pCR,cCR,治疗完成率,阴性手术切缘和 SSS 比例。通过 Fisher 的精确检验,报告的 p 值均为双侧检验。
结果:从 2016 年 10 月至 2018 年 2 月,178 名患者随机分组(88 名对照组,90 名 veliparib 组)。除入组时,两组可行 SSS(保留括约肌)的患者不平衡外(39% 对照,61%veliparib),两组基线特征基本平衡。总共 140 例患者可评估 NAR(72 对照组,68 veliparib 组)。平均 NAR 评分,对照组为 12.6(95%CI:9.8-15.3),而 veliparib 组为 13.7(CI:10.2-17.2)。校正分层因素(p = 0.69)或者校正分层因素与可行 SSS 患者比例(p = 0.78),两组 NAR 差异不显着。pCR 率分别为 对照组 21.6%vs. 试验组 33.8%(p = 0.14);cCR = 28.2%vs. 33.3%(p = 0.60);SSS(保肛比例)分别为 52.5% 对比 59.3%(p = 0.43)。最常见的 3/4 级 AE 是腹泻和血细胞减少。试验组有 2 例患者死亡(1 例心脏骤停;1 例为放化疗后肠炎)。
结论:作为全新辅助治疗的一部分, PARP 抑制剂 Veliparib(维利帕尼)联合同步放化疗是安全可行的,未出现不可预测的短期不良反应,但初步结果联合治疗并未改善 NAR 评分。
临床试验信息:NCT02921256
3507
FOLFOX+贝伐单抗对比 FOLFOXIRI+贝伐单抗(BEV)一线治疗基线循环肿瘤细胞(bCTC)≥ 3 的转移性结直肠癌患者的随机 III 期研究
Javier Sastre,Hospital Cl´ınico San Carlos, Instituto de Investigacio´ n Hospital Clinico SanCarlos (IdISSC), Madrid/Spain, CIBERONC, Madrid, Spain
译者:谢晓煜
背景:在晚期结直肠癌患者一线治疗中,FOLFOXIRI+贝伐单抗对比 FOLFIRI+贝伐单抗有生存获益(TRIBE LancetOncol 2015)。然而由于安全性问题,此方案并不适合所有患者。既往研究表明 bCTCs ≥ 3 个是影响预后的重要因素(MACRO TheOncologist 2012)。VISNU-1 临床试验对比 FOLFOX+BEV 与 FOLFOXIRI+BEV 方案在 bCTCs ≥ 3 的 mCRC 中的疗效。研究的主要终点为疾病无进展生存期(PFS),次要终点为总缓解率(ORR)和总生存期(OS)。
方法:该研究为一项开放、随机、多中心的临床 III 期研究,入组患者为年龄小于 70 岁、ECOG 0-1 分的 mCRC,随机分配到 FOLFOX+BEV (A 组) 和 FOLFOXIRI+BEV(B 组),并按 KRAS(突变或野生)和受累器官数目(1 或者>1)进行分层分析。
结果:ITT 人群中包括 349 例患者,其中 A 组 177 例、B 组 172 例。所有患者的临床特征、分子分型和安全性分析结果已在 2018 年 ASCO 会议上发表,这表明此研究设计的毒副作用是可接受的。ITT 人群的疗效分析如下表所示。
结论:在预后非常差的人群中,本研究达到其主要终点。接受 FOLFOXIRI+Bev 的患者有统计学意义的 PFS 和 ORR 获益。OS 在实验组中显示出有获益的趋势。根据研究结果,FOLFOXIRI+Bev 可被认为是 bCTCs ≥ 3 的 mCRC 患者适当的治疗选择。
临床试验信息:2012-000846-37
3508
TRIBE2 结果更新:不可切除 mCRC 一线和二线治疗的随机对照策略研究
Chiara Cremolini,Department of Translational Research and New Technologies in Medicine andSurgery, Unit of Medical Oncology 2, Azienda Ospedaliera Universitaria Pisana,Pisa, Italy
译者:谢晓煜
背景:在 III 期 TRIBE 研究中,与 FOLFIRI/bev 作为 mCRC 初始治疗相比,FOLFOXIRI/bev 显著改善了反应率(RR)、PFS 和 OS。然而,与预先计划的双药序贯策略(FOLFOX,FOLFIRI)相比,三药的实际优势可能较低。TRIBE2(NCT02339116)是一项 III 期试验,未经治疗的不可切除的 mCRC 按照 1:1 随机到两个治疗组。组 A 先采用 FOLFOX/bev 方案,5-FU/bev 方案维持直到疾病进展,后采用 FOLFIRI/bev 方案;组 B 先采用 FOLFOXIRI/bev 方案,然后 5-FU/bev 方案维持直到疾病进展,进展后再重现引入 FOLFOXIRI/bev 方案治疗。预先计划的中期分析显示,就研究的主要终点 PFS2 而言,B 组具有显著优势。PFS2 定义为在首次 PD 或死亡(PD2)后随机给予的任何治疗至 PD 的时间。
方法:该研究有 80% 的能力检测 PFS2 的 HR 值为 0.77,有利于 B 组,总体双侧误差为 0.05(中期和最终分析分别为 0.0131 和 0.0455、预设 303 例和 466 例 PFS2 事件)。次要终点包括 RR、1st-PFS[从随机到 PD 或死亡(PD1)的时间]、2nd-PFS[从 PD1 到 PD2 的时间] 以及 OS。
结果:从 2015 年 2 月至 2017 年 5 月,来自意大利 58 个中心的 679 例患者入组(A 组/B 组:340/339)。主要特征是(A 组/B 组):右半结肠 38%/38%,同时性转移 89%/89%,RAS 突变 65%/63%,BRAF 突变 10%/10%。中位随访时间为 30.6 个月,共有 514 例 PD2(A/B:272/242)、594 例 PD1(A/B:303/291)和 408 例 OS(A/B:217/191)事件被收集。前期采用 FOLFOXIRI/bev 方案的显著优势在 PFS2(19.1 vs16.4mos, HR 0.74, 95% CI 0.62-0.88, p<0.001)、RR(62% vs 50%, OR1.61, 95% CI 1.19-2.18, p = 0.002)和 1st-PFS(12.0 vs 9.8mos,HR 0.75, 95% CI 0.63-0.88, p<0.001)方面得到证实。研究还观察到 B 组患者有显著的 OS 获益(27.6 vs22.6mos, HR: 0.81, 95%CI: 0.67-0.98, p = 0.033)。在 594 例 PD1 事件中,470 例患者(79%,A/B 组:251/219)在 PD 后接受治疗。在按方案分析(N = 323)中,B 组患者的 2nd-PFS 显着延长(6.5 vs 5.8 mos,HR 0.76, 95%CI 0.59-0.97, p = 0.024)。
结论:不可切除的 mCRC 中,与 FOLFOX/bev 和 FOLFIRI/bev 的预先计划序贯给药相比,前期采用 FOLFOXIRI/bev 方案在 PD 之后重新引入相同方案治疗提供了统计学上显著且临床相关的 PFS2 和 OS 获益。尽管预后特征较差的患者比例较高(RAS 和 BRAF 突变、右半结肠、同时性转移),但中位 OS 达到 27.6 个月。
临床试验信息:NCT02339116
3509
CAPTEM 对比 FOLFIRI 在 MGMT 甲基化、RAS 基因突变型转移性结直肠癌二线治疗的随机对照 II 期研究
FilippoPietrantonio, Fondazione IRCCS Istituto Nazionale dei Tumori, Milan, Italy
译者:蔡月
背景:替莫唑胺(TMZ)对经甲基化特异性 PCR(MSP)检测,存在 MGMT 甲基化的难治性转移性结直肠癌的客观有效率(ORR)约 10%。含伊立替康方案二线治疗研究的 ORR 约 4-16%。提早至前线治疗联合应用或除 MSP 方法以外的分子标志物选择可能提高替莫唑胺疗效。免疫组化 MGMT 表达缺失、甲基化 BEAMing(MB)检测中 MGMT 的高表达可能提示更高的 ORR 及更长的 PFS。
方法:此项多中心、随机对照 2 期研究旨在探索经中心 MSP 确定的 MGMT 甲基化、RAS 突变型 mCRC,CAPTAM 方案(组 A:卡培他滨 750 mg/㎡,bid,第 1-14 天;替莫唑胺 75 mg/㎡,bid,第 10-14 天,每 28 天重复)二线治疗的 PFS 是否优于 FOLFIRI 方案(组 B)。入组患者:ECOG PS 0-1 分,有可评估病灶,含奥沙利铂方案一线治疗失败(或含奥沙利铂方案辅助治疗后 6 个月内复发)。随机分层因素包括奥沙利铂方案治疗开始至肿瘤进展(PD)时间(<或 ≥ 9 个月)、前线贝伐单抗使用情况(有或无)。预期 mPFS 从 2 个月延长到 4 个月,α= 5%,β= 90%,单侧秩和检验的样本量为 82 例 (每组 41 例)。次要研究终点:安全性,QoL,OS,ORR。探索性研究终点:MGMT 免疫组化对比 MB 方法检测的预测值。
结果:2014 年 11 月至 2019 年 2 月,18 家意大利医疗中心共随机入组 82 例患者(组 A/B:41/41 例)。基线临床特征(组 A/B)分别为: 男性占 44/56%,中位年龄为 70/67 岁,ECOG PS 评分 0 者占 54/51%,右侧结肠肿瘤占 37/39%,仅有 1 个转移部位者 44/34%,前线贝伐单抗使用占 68/66%,一线 PFS 分别为 9.4/10.2 个月。
中位随访时间 26.6 个月,共收集到 70 例 PFS 和 46 例 OS 事件。组 A 对比组 B 的 mPFS 为 3.6 个月对比 4.1 个月(HR = 1.26;95%CI0.60-1.94;p = 0.79)。组 A 和组 B 的 ORR 分别为 12% 和 10%,DCR 均为 51%。3-4 级不良反应发生率(组 A/B)分别为:15% 和 44%(其中腹泻 0/12%,口腔粘膜炎 0/7%,贫血 2/10%,中性粒细胞减少 2/22%,血小板减少 7/0%。)MGMT 免疫组化及 MB 检测均不能反映预后。
MGMT 免疫组化阳性表达亚组(组 A 12 例,组 B 22 例):组 A 和组 B 的 mPFS 为 2 个月对比 4.1 个月(HR = 2.06;95%CI0.96-4.45;p = 0.06),mOS 为 6.4 个月对比 10.6 个月(p = 0.78);ORR 为 0% 对比 14%,DCR 为 25 对比 55%(OR = 0.28;95%CI 0.06-1.31;p = 0.11)。
MGMT 免疫组化阴性表达亚组,两个方案的 PFS、OS、ORR 和 DCR 均无差异。不同治疗组免疫组化交互 P 值分为别:PFS 0.171,OS 0.917,DCR 0.06,与 MB 检测法准确度相似。
结论:将开展一项探索替莫唑胺治疗免疫组化 MGMT 阴性/MGMT 高甲基化表达的 mCRC 患者的 3 期研究。
临床试验信息:NCT02414009
3510
根据 UGT1A1 状态,对比卡培他滨联合或不联合伊立替康在局部进展期直肠癌新辅助放化疗的一项多中心、随机对照、3 期临床研究(CinClare)
Zhen Zhang, Department of Radiation Oncology,Fudan University Shanghai Cancer Center, Shanghai, China
译者:蔡月
背景:本中心 1/2 期研究已经证实根据 UGT1A1 基因分型确定伊立替康剂量的新辅助放化疗可改善病理完全缓解率(pCR)。3 期研究旨在进一步探索伊立替康联合卡培他滨同期放化疗新辅助治疗局部晚期直肠癌的疗效。
方法:2015 年 11 月至 2017 年 12 月,我们在中国开展了一项前瞻性、随机、开放性、多中心 3 期临床研究。cT3-4 或 N+直肠腺癌患者随机入组。对照组(组 A,N = 180)接受盆腔放疗,50 Gy/25 次,同时联合卡培他滨 825 mg/㎡,每天 2 次,第 1-5 天,每周重复;放化疗结束后两周接受 1 程 XELOX 方案化疗。试验组(组 B,N = 180)接受同剂量的盆腔放疗,卡培他滨 625 mg/㎡,每天 2 次,第 1-5 天,每周重复;同时联合伊立替康每周重复。伊立替康剂量根据 UGT1A1 基因型决定:UGT1A1*1*1 型为 80 mg/㎡,UGT1A1*1*28 型为 65 mg/㎡,放化疗结束后 2 周接受 1 程 XELIRI 方案。主要研究终点是 pCR 率。临床试验登记号:NCT 02605265。
结果:组 A 和组 B 接受手术患者分别为 86.5% 和 88.2%,其中经腹会阴联合切除者分为别 38.9% 和 30.5%。组 A 和组 B 的 pCR 率分别为 17.5% 和 33.8%(p = 0.001)。两组分别有 4 例和 6 例患者临床完全缓解(cCR)超过 12 个月。CR 患者(包括 cCR 和 pCR),组 A 为 17.4%,组 B 为 33.1%(p = 0.001)。两组最常见的 3-4 级不良反应分别为白细胞减少(3.4% 对比 13.5%),中性粒细胞减少(1.7% 对比 19.7%)和腹泻(1.7% 对比 13.5%)。两组的手术并发症发生率(11.0% 对比 14.6%)无统计学差异。
结论:根据 UGT1A1 状态,在卡培他滨为基础的同期新辅助放化疗加入伊立替康可显著增加肿瘤完全缓解。治疗的毒性有所增加但耐受良好。该治疗方法可作为等待观察治疗策略的选择。
临床试验信息:NCT 02605265
3511
随机 II 期 VOLFI 试验(AIO-KRK0109)的最终结果和 OS:mFOLFOXIRI +帕尼单抗与 FOLFOXIRI 作为 RAS 野生型转移性结直肠癌(mCRC)患者的一线治疗
Michael Geissler, Klinikum Esslingen,Department of Internal Medicine, Oncology/Hematology, Gastroenterology,Esslingen, Germany
译者:胡华斌
背景:该试验评估了 mFOLFOXIRI +帕尼单抗对比 FOLFOXIRI 在 ECOG 0-1 分的不可切除的 mCRC 患者的有效性和安全性。最终的主要终点已经在 2018 年的 ASCO 和 ESMO 上进行了报道。现在我们首次报告 OS 和 PFS 的最终结果。
方法:该研究为前瞻性 2:1 随机对照的开放多中心 II 期试验,比较 mFOLFOXIRI(Ox 85 mg / m2,Iri 150 mg /m2,5-FU 3000 mg / m2 cont.48 h,LV 200 mg / m2)+ Panitumumab(6 mg / KG)(A 组)和 FOLFOXIRI(Ox 85 mg / m 2,Iri 165 mg / m2,5- FU 3200 mg /m 2,持续 48 小时,LV 200 mg / m2)(B 组),均为每 2 周一次方案。前瞻性分层为队列 1:不可切除的 mCRC(n = 65),队列 2:转移性病灶有机会切除的机会(n = 31)。主要终点是 ORR,次要终点是二次切除率(队列 2)、DCR、PFS、OS 毒性和生活质量(QLQ-C30)。
结果:共有 96 名患者随机分组(63 例 A 组,33 例 B 组)。A 组的 ORR 为 87.3%,B 组为 60.6%(p = 0.0041,OR 4.47; 95%-CI1.614-12.376)。ITT 人群中转移病灶的二次切除率观察为 33.3%(A 组)与 12.1%(B 组)(OR = 3.63; 95%-CI 1.13-11.67,p = 0.029),在队列 2 中分别为 75%(A 组)和 36.4%(B 组)(OR = 5.25; 95%-CI 1.07-25.8,p = 0.05)。两组的中位 PFS 相似(均为 9.7 个月,HR 1.071; 95%-CI0.689-1.665,p = 0.76)。 ITT 人群的 OS 数据显示出含 Pmab 的 A 组优于 B 组的强烈趋势,中位 OS 为 35.7 个月,而 B 组为 29.8 个月(HR:0 . 7; 95%-CI 0.41-1.11,P = 0.12 )。队列 2 中的两组的中位 OS 分别为 52.0 个月和 41.6 个月(HR 0.413; 95%-CI 0.15-1.12,p = 0.07)。
结论:在 RAS 野生型 mCRC 患者中在 mFOLFOXIRI 方案中增加 Pmab 显着改善了客观反应率和转移瘤的二次切除率。尽管 PFS 相似,但 Pmab 组的 OS 显示出优于单纯化疗组的趋势。未来的研究有必要证实这一趋势可以改善患者的整体生存率。
临床试验信息:NCT01328171
3512
CCTG CO.26 研究:PD-L1 单抗 Durvalumab (D) 联合 CTLA-4 单抗 Tremelimumab (T) 加最佳支持治疗对比最佳支持治疗在复发性转移性结直肠癌的 II 期临床研究:更新分析血浆检测 MSS 和肿瘤突变负荷 TMB 对疗效的影响
EricXueyu Chen, Princess Margaret Cancer Centre, University Health Network,Toronto, ON, Canada
译者:张剑威
背景:靶向 PD-L1 和 CTLA-4 是具有协同作用的免疫治疗方法,CO.26 研究评估了双重抑制对比最佳支持治疗是否可改善转移性结直肠癌患者生存。
方法:rmCRC 患者按 2:1 随机分至 (D +T) 与 BSC 组,治疗组为 D(1500 mg)D1 每 28 天重复,前 4 个疗程同时联合 T 药(75 mg)D1 治疗,并同时采用支持性措施。主要终点是总生存期(OS)。双侧 p<0.10 认为具有统计学意义。使用 GuardantOMNI panel 和基线血浆,通过细胞游离 DNA(cfDNA) 测序检测 MSI 和 TMB。
结果:从 2016 年 8 月至 2017 年 6 月,纳入 180 名患者。两组基线特征平衡。中位随访时间为 15.2 个月, D + T 组中位 OS 为 6.6 个月,BSC 组为 4.1 个月(p = 0.07; HR:0.72,90%CI:0.54 - 0.97)。无进展生存期(PFS)分别为 1.8 mos 和 1.9mos(HR 1.01,90%CI 0.76-1.34)。
疾病控制率(DCR)对于 D + T 组为 22.6%,BSC 组为 6.6%(p = 0.006)。 cfDNA 在 168/169 分(99.4%)中可分析。两例患者为 MSI-H,166 例患者为 MSS,OS 的 HR 为 0.66(p = 0.024; 90%CI, 0.49-0.89)。排除 MSI-H 病例(TMB 为 74.7 和 247.1 mts / Mb),平均 TMB 为 20.4±16.3 mts / Mb(范围:0.96 - 114.0)。在 MSS 患者中,按预设的 20 mts / Mb 为截点将患者分为高 TMB 和低 TMB 组,这里 TMB 不能预测 OS,PFS 或 DCR(相互作用 p 值>0.7)。使用最小 p 值方法,TMB>28 mts / Mb(占 21% 的 MSS)的患者对于 D + T 具有最大的 OS 获益(HR 0.34,90%CI 0.18-0.63)(相互作用 p = 0.07)。在 BSC 组中,使用 20mts / Mb(HR 1.26,90%CI,0.76-2.12)和 28 mts / Mb(HR 2.59,90%CI 1.46-4.62)切点,高 TMB 均与 BSC 组中 OS 预后较差的趋势相关。
结论:D + T 显着延长了复发性转移性结直肠癌患者的 OS。在 MSS 的患者中,高 TMB 的患者可从 D+T 治疗中获益;在 BSC 组中,血浆 TMB 是预后因素。这是第一项显示 PD-L1 和 CTLA-4 治疗可延长 MSS 的转移性结直肠癌患者生存期的研究。研究在死亡患者超过 90% 时进一步更新结果。
3513
使用前瞻性 IDEA 研究法国队列(PRODIGE-GERCOR)验证免疫评分在奥沙利铂辅助治疗的 III 期结肠癌患者中的预后作用
FranckPages, INSERM, Laboratory of Integrative Cancer Immunology, Equipe Labellise´ eLigue Contre le Cancer, Paris, France
译者:吴泽华
背景:免疫评分(IS)显示出对 I-III 期结肠癌患者(CC)的预后分类作用,本研究中将用于评估 IDEA 研究法国队列——一项基于奥沙利铂 3 个月对比 6 个月辅助化疗治疗 III 期结肠癌患者的研究。
方法:通过数字化病理学方法将每名患者肿瘤中心及边缘的 CD3+和 CD8+T 淋巴细胞密度量化并转化为 IS 评分,评分使用的是既往定义且已发表的截止值。在每个研究组中,在调整的意向治疗人群中评估 IS 预测无疾病生存(DFS)的作用,并与相关临床特征使用多变量 Cox 模型进行多变量分析。Harrell’s C 统计用于评估 IS 的作用。
结果:总共纳入 1322 例患者,82 例由于预分析不合格被剔除。免疫评分最终在 1062(85.6%)例合格患者中进行。二分类的分析中,免疫评分低和评分中高的患者分别为 599 (43.6%) 和 463 (56.4%)。免疫评分与 T 分期、T/N 分期(T1-3N1 对比 T4 和或 N2)以及微卫星状态相关。研究达到主要研究目的,验证了低免疫评分区分高复发或死亡风险的患者 [HR = 1.54; 95%CI 1.24-1.93, p = 0.0001]。低免疫评分与中高免疫评分患者 3 年 DFS 率分别为 66.80% [95%CI 62.23-70.95] 和 77.14% [95%CI 73.50-80.35]。与 T/N 分期共同进行多因素分析时,免疫评分仍是 DFS 的独立相关因素 (p,0.0012) 。T/N 分期中加入免疫评分显著提高模型的辨别能力 [bootstrapC index mean difference, 0.022; 95%CI 0.005-0.04]。此外,免疫评分做为三分类变量(低、中、高)以及作为一个连续变量也与 DFS 显著相关(p 值均为 0.001)。单因素分析中,免疫评分与 6 个月治疗组 DFS 相关 (p,0.0001),3 个月治疗组中也观察到类似的趋势 (p = 0.09)。
结论:免疫评分在前瞻性 IDEA 研究法国队列中确认可作为 III 期结肠癌患者 DFS 的一个预后因素。
临床研究信息:NCT03422601
3514
Ipilimumab 和 nivolumab 联合放疗治疗微卫星稳定型(MSS)转移性结直肠腺癌(mCRC)的一项 II 期研究
AparnaRaj Parikh, Massachusetts General Hospital, Boston, MA
译者:吴泽华
背景:转移性结直肠癌仍是一个致死性肿瘤,免疫治疗在 MSS 转移性结直肠癌中仍未有显著疗效。临床前研究模型中,放疗诱导的细胞损伤可能通过远隔效应提高免疫治疗疗效,证明放疗与双检查点阻断治疗具有协同作用。本研究评估了 CTLA-4 和 PD-1 双检查点阻断剂联合放疗刺激 MSS 转移性结直肠癌患者免疫反应的治疗策略。
方法:本研究为一项开放性,单臂,II 期研究,纳入 40 例 MSS 转移性结直肠癌患者。符合条件的患者需为组织学证实的 MSS 转移性结直肠癌,ECOG 评分 0-1 分且至少两线治疗进展。治疗方案包括 ipilimumab (1 mg/kg 每六周)、nivolumab (240 mg 每两周) 以及在第 2 周期每隔一天进行放疗(8 Gy3 分次)。治疗持续直到疾病进展、停药或撤回知情同意。主要研究终点是疾病控制率(DCR), 每 3 个月进行一次影像学评估。探索性研究终点包括 ORR,PFS,OS 以及安全性。治疗反应定义为放射野外的疾病控制。在治疗前、仅进行双检查点阻断剂治疗时(第一周期)以及放疗后 2 周进行系列肿瘤活检。意向性分析包括至少接受一次研究药物治疗的所有患者。
结果:2017 年 7 月至 2018 年 12 月,共 40 名患者(中位年龄 59 岁 (26-83),58% 男性)入组且开始治疗。ITT 人群 DCR 为 17.5% (7/40),ORR 为 7.5%(3/40)。ITT 人群中位疾病控制时间为 77 天,3 个月时进行影像检查疾病控制患者(n = 7)或删失患者(n = 3)为 252 天,PD 患者(n = 17)或由于临床进展没有放疗患者(n = 13)为 70.5 天,调整 ITT 人群(所有接受放疗和再分期患者)为 24 例,不包括一例患者放疗后等待第一次扫描患者,DCR 为 29.2% (7/24) ,ORR 为 12.5% (3/24)。mITT 人群中位疾病控制时间为 77.5 天,疾病控制患者 252 天,PD 患者 77 天。治疗相关不良事件发生为 22/40 (55%)。20/40 (50%) 患者发生 3 级不良事件,包括疲乏、恶心、呕吐、腹泻,输液相关反应,呼吸困难是最常见不良反应。1 名患者 (2%) 死于呼吸衰竭,且可能与治疗相关。
结论:CTLA-4 和 PD-1 双检查点抑制剂联合放疗在 MSS 转移性结直肠癌中可行且具有持久疗效。3 名患者没有完成放疗或没有进行放疗后再分期。我们将在研究完成后更新疗效数据并报告相应肿瘤系列活检结果。
临床研究信息:NCT03104439
封面图来自站酷 PLUS