
BioCMC已经成功举办五届致力于搭建中国生物药企业、全球领先生物制药公司交流合作以及促进行业人才成长的最佳平台。本次峰会预计将有1000人的参会规模,围绕生物药多个细分品类:抗体蛋白、细胞治疗药物、基因治疗药物、mRNA药物。从宿主细胞/细胞系/细胞株,上游培养,质量控制,下游纯化,杂质检测/分析,工艺变更/验证/优化,生产,质量管理,制剂等环节对抗体药物上下游、制剂供应链进行梳理,加快新药快速开发,保证产品质量,降低成本加快商业化生产。从全球细胞与基因治疗监管法规,基因修饰产品的安全性、工艺研究/开发/验证、分析方法、质量管理;mRNA从设计到生产全流程解析,探索最前沿技术及CMC工艺开发与商业化生产热点难点问题。
第六届中国生物药CMC国际峰会 | BioCMC Summit
举办时间丨2022年10月18-19日
举办地点丨中国 · 苏州香格里拉大酒店
主办单位丨百世传媒|Best Media、中国药学会制药工程专业委员会
支持单位丨百世药学院、药方舟
合作媒体丨贝壳社、风云药谈、会会药咖、生命奥秘、好思康/生物咖啡茶、生物探索、生物通、TIMEDOO、药渡、药智网、医谷网、制药在线、中国生物器材网、中美健康咨询网
参会注册通道及展商参展通道现已开通
期待与您相会苏州
BioCMC 2022 赞助商

BioCMC 2022 演讲嘉宾

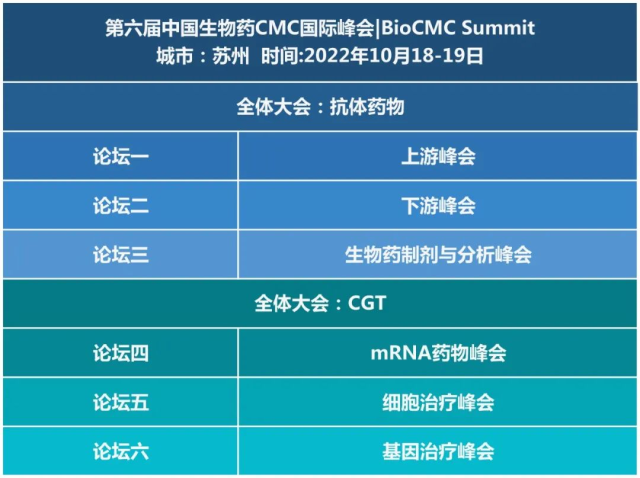
BioCMC 2022 会议议程
全体大会:抗体药物
连续流、数字化等新技术在生物药生产中的应用前景及生物药未来发展趋势分析
刘洵,CTO,瓴路药业
新形势下生物药申报过程中CMC面临的挑战和应对策略
贯穿生物药整个产品开发生命周期中的法规要点分析
如何更快研发出性价比更高的治疗性生物药
生物药国际化过程中侵权风险的评估和应对策略
分论坛一 上游峰会
缩短细胞株开发加快IND申报的难点分析
王敏,总监,迈威(上海)生物科技股份有限公司
细胞株来源的清晰化:符合药监局和知识产权的要求
Karen Twu,生物药CMC部门副总裁,和黄医药
CHO 细胞株前世今生——开发和工艺视角
James Yang,首席战略发展官,华润生物医药有限公司
宿主细胞工程化的考量
赵民,副总裁,英诺湖医
抗体融合蛋白等复杂糖蛋白的质量控制策略
袁志军,CMC AD&QC leader、Early Discovery成药性评估平台负责人,普米斯生物技术(珠海)有限公司
大规模细胞培养放大技术
马宁宁,特聘教授,沈阳药科大学
工艺可开发性在加速创新生物药开发中的应用
张彦丰,共同创始人兼总裁,AlaMab Therapeutics
ADC药物工艺开发及质量研究
秦民民,高级副总经理,上海美雅珂生物技术有限责任公司
工艺开发过程中细胞株变更带来的影响
CHO细胞高产量稳定表达的影响因素
分论坛二 下游峰会
Late phase病毒清除验证的设计方案
游明翰,CMC 高级总监,海南赛乐敏生物科技有限公司(香港中国抗体集团成员)
生物药从开发到上市过程质量的管理
李孟捷,执行总监,三生国健(上海)
生物药生产过程稳定性的研究(拟)
潘志卫,CMC负责人,苏州君盟/君实生物
抗体生产新工艺的开发
李建伟,首席运营官,江苏赛孚士生物技术有限公司
基于监管视角对BLA商业化阶段技术转移和生产过程风险管理的思考
JohnZhang,VP of Biologics CMC,Zai Lab
上市后变更解读
黄玮,COO & SVP,复宏汉霖
不同阶段HCP检测和质控
生物药潜在杂质的分析检定
生物药下游病毒去除/灭活工艺的安全性研究
双抗药物纯化要点分析
分论坛三 生物药制剂与分析峰会
生物药高端制剂的开发
刘翠华,高级副总裁,百奥泰生物
高浓度蛋白制剂的开发及面临的挑战
韩冬梅,产程开发下游和制剂部副总经理,复宏汉霖
双抗分子制剂开发策略
林军,CMC 副总裁,嘉和生物
工艺变更可比性分析
谢红伟,产品开发部副总裁,信达生物
高浓度蛋白粘度降低技术及其应用
汪烨峰,市场技术经理,默克
配伍稳定性和运输验证研究的挑战和策略
郑小红,COO,前沿生物药业(南京)股份有限公司
ADC药物的处方开发
抗体药物处方开发过程的考量
创新药制剂开发的策略
生物药制剂工艺表征的研究
全体大会:CGT
全球CAR-T细胞新药研发的最新进展和未来发展趋势
杨林,创始人/董事长,博生吉医药科技(苏州)有限公司
加速mRNA药物开发的策略
回爱民,前高级副总裁、全球研发总裁兼首席医学官,复星医药
新型细胞和基因治疗的技术工艺前沿动态与挑战
细胞和基因治疗商业进程面临的挑战与风险分析
细胞和基因治疗在监管方面面临的难题,如何与监管机构进行沟通
分论坛四 mRNA药物峰会
mRNA分子的结构设计和CMC策略
张育坚,执行副总裁(EVP),斯微(上海)生物科技股份有限公司
mRNA共转录工艺研究及帽类似物、修饰核苷酸在其中的应用
肖潇,联合创始人,申基生物
mRNA体外合成效率的探索
范伦祥,创始人、CEO,杭州富纳生物医药技术有限公司
mRNA新冠疫苗从设计到生产全流程解析
李涛,mRNA技术平台负责人,高级主任,药明生物
确保mRNA疫苗质量和安全性:现状与未来趋势
Sarita K. Acharya,全球生物制品部门首席科学家,美国药典委员会
mRNA IVT反应一步法和两步法工艺的选择及分析
朱涛,联合创始人,首席科学官,康希诺生物股份公司
环状mRNA及其CMC工艺开发要点
左炽健,研发总监,苏州科锐迈德生物医药科技有限公司
mRNA疫苗商业化生产的工艺路线
熊长云,集团副总裁、mRNA生产负责人,艾美疫苗
新型药物载体的开发:外泌体
许可,董事长/CEO,苏州唯思尔康科技有限公司
新型可电离脂质构建的LNP对mRNA递送的影响
宋相容,常务副总经理/教授,成都威斯津生物医药科技有限公司/四川大学
mRNA递送技术的专利策略和侵权风险防控
赵李祥,教授,苏州大学
mRNA疫苗递送面临的挑战与未来方向
王弈,联合创始人、CEO,深圳市新合生物医疗科技有限公司
小颗粒,大革新—把新冠mRNA疫苗导到细胞内的LNP技术
徐松林,执行副总裁,浙江海昶生物医药技术有限公司
分论坛五 细胞治疗峰会
细胞治疗产品IND申请CMC的要点分析
齐菲菲,联合创始人&CTO,北京艺妙神州医药科技有限公司
细胞治疗相关的生物安全性检测
林巧,创始人&CEO,驾玉生物
细胞制剂CMC的国内外趋势
同种异体CAR-T细胞用于实体瘤治疗的开发实践
尚小云,创始人、首席执行官,苏州茂行生物科技有限公司
CAR-T产品密闭连续自动化生产面临的挑战
David He,CTO& EVP,驯鹿医疗
中国细胞治疗药企在美国FDA申报的战略考量
姚毅,前美国FDA资深医疗评审官
iPSCs细胞药的CMC
袁宝珠,主任,上海张江国家干细胞自主创新产业示范区质量控制中心
CAR-T产品细胞放行检测和质量控制
James Wang,CTO,合源生物
CAR-T细胞药物全自动制备工艺的意义、前景及质量控制
汪敏,高级技术总监,博生吉医药科技(苏州)有限公司
细胞治疗产品生产用材料的质量标准策略
分论坛六 基因治疗峰会
高效靶向AAV基因治疗技术开发
于道展,CEO,AAVnerGene Inc
AAV病毒药物开发的挑战
吴凤岚,联合创始人兼总裁,苏州华毅乐健
基因治疗乙肝病毒载体平台及其在治愈乙肝中的作用
王子元,董事长,首席科学家 ,湖景(苏州)生物制药有限公司
基因治疗产品IND申报面临的挑战
高杨,首席战略官,上海邦耀生物科技有限公司
细胞基因治疗全流程运营管理的挑战
施伟,运营副总裁,启函生物
病毒载体技术在新冠肺炎治疗中的应用
董文吉,创始人,董事长&CEO,中吉智药(南京)生物技术有限公司
AAV载体的关键质量属性表征与分析
董飚,董事长、总经理,四川至善唯新生物科技有限公司
国产化设备物料在腺病毒载体新冠疫苗生产中的应用
梁旻,总经理,上海锦斯生物技术有限公司
AAV基因疗法从实验室规模到生产规模工艺放大面临的挑战
基因治疗产品工艺验证的要点分析
联系人:Luke Xia
电话:021-60538962
手机:133-0185-8344
邮箱:luke.xia@bestmediaworld.com
峰会官网:http://www.bestmediaworld.com/biocmc/